EN ISO 13485認証

品質マネジメントシステム規格EN ISO 13485認証
医療機器、製品およびサービスを対象とした確実な品質マネジメントシステム(QMS)を導入し、維持することで、ビジネスを支える基盤を築くことができます。QMSに対するEN ISO 13485認証取得により、国際規格に沿った取り組みを示すことができます。
EN ISO 13485認証プロセスでは、品質マネジメントシステムの能力および信頼性を検証するために現地審査を行います。テュフ ラインランドの専門家は、設計、開発、製造およびサービスの分野において、実際の適用および有効性について評価します。
テュフ ラインランドは、グローバルに認知されているノーティファイドボディとして、広範囲の認定を受けているので、世界各地で認証サービスを行っています。各企業のビジネスニーズに合わせた包括的なサービスをワンストップで提供します。
EN ISO 13485認証のメリット
国際的に認知されているEN ISO 13485に基づく品質マネジメントシステムを採用した製造ラインを構築することは、医療機器(クラスIを含む。)製品にとって大きなメリットです。認証を取得することで、市場に容易に参入できるようになり、市場を拡大させることが可能になります。医療機器のメーカーおよびサプライヤーは、QMS認証を取得することで、TCP、MDR、IVDRおよびMDSAPなど他の認証もスムーズに取得することができます。ベンチャー企業にとってEN ISO 13485認証取得は、市場での優位性や将来の成長および事業の拡大が期待できます。審査に向けた準備作業は、医療機器業界に身を置くすべての事業者にとって、QMSプロセスおよびワークフローを改善する良い機会にもなります。
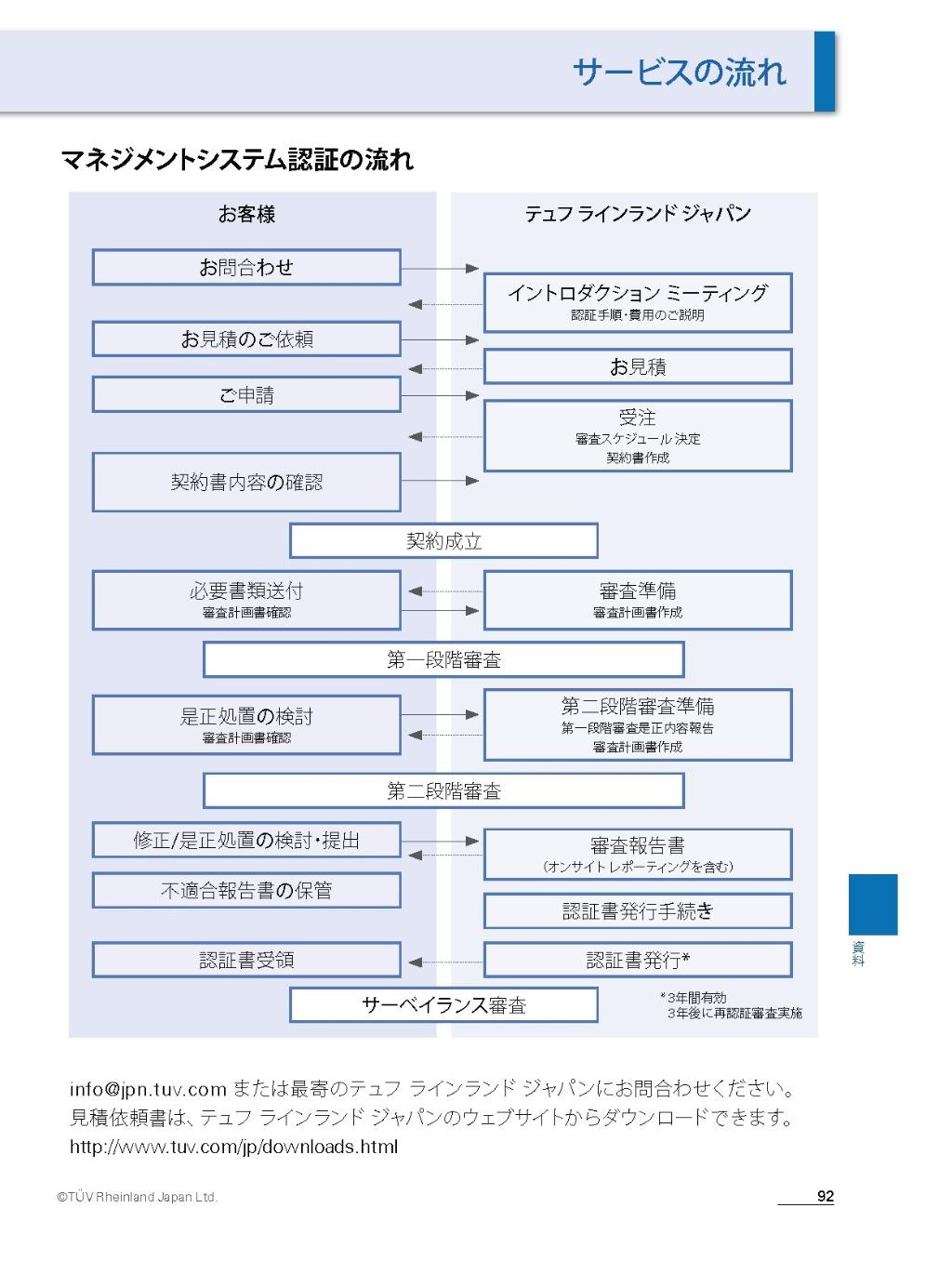
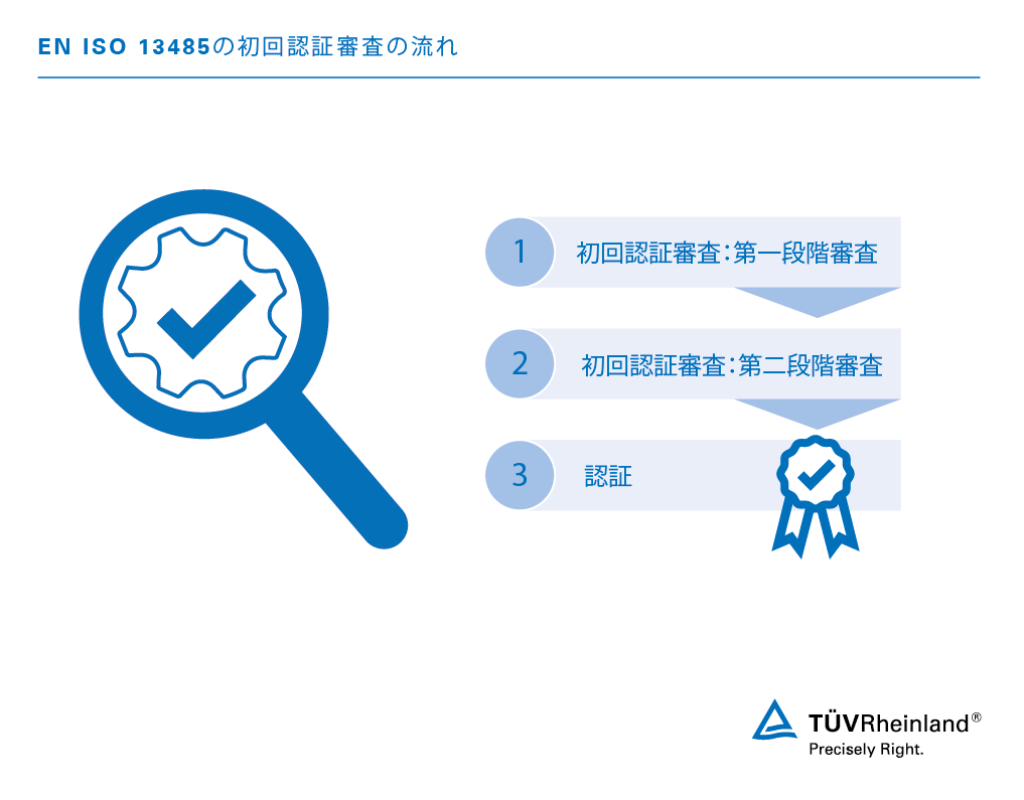
EN ISO 13485認証取得までの4つのステップ:
- 第一段階審査
現地審査、品質マネジメント文書分析およびビジネスアセスメントの結果から認証取得要件を満たしているか評価。 - 第二段階審査
実際の適用および有効性に関して優れているかどうか品質マネジメントシステムを現地評価。 - 認証
品質マネジメントシステムが完全に整っている状態であること、および規格に準拠しているか適合性を確認。
初回申請者は、予備審査を受けることで、正式なEN ISO 13485審査プロセスに向けて、適時かつ効果的に準備をしやすくなるというメリットを得られます。予備審査結果は文書でお渡しするため、審査本番前に、直ちにその結果を適用してプロセスを改善することができます。
認証更新申請に加えて、認証移管申請も受け付けています。
テュフ ラインランドは、二重チェックの原則に基づいて審査します。すなわち、審査チームおよび技術専門家による評価後に独立した審査を行って最終判断を下すことになっています。
認証取得には経験豊富なテュフ ラインランドをパートナーとしてお選びください
テュフ ラインランドは、グローバルに活躍しているノーティファイド・ボディです。EN ISO 13485規格の専門家が世界各地でお客様のビジネスをサポートします。認証取得や新規市場への参入を検討される際は、テュフ ラインランドにお任せください。新規市場に参入する際に必要な認証や世界市場の情報についてご相談いただければ、お客様のニーズに沿ったサービスを提案します。
/tuv-rheinland-japan-official-blog-for-medical-image_core_1_x.jpg)
テュフ ラインランド ジャパン 公式ブログ
では、
・最新規制情報
・専門家の声
・お客様の事例
をブログにてご紹介しております。
最新情報を、ぜひ業務にお役立てください。
公式ブログは こちら
各国規制・認証検索サービス、国際規制情報
各国規制・認証検索では、現地試験の必要性や認証の有効期限など、各国の規制・認証の概要を英語で提供しています。国際規制情報では、世界の規制・国際規格に関する最新情報を英語で提供しています。
オンラインマガジン「tuv.communication」配信登録

月に一度、テュフ ラインランドの最新情報をまとめて、皆さまにオンラインマガジンとしてお届けしています。国際規制情報・新サービス・事例紹介・セミナー情報などをまとめて取得できます。ぜひこの機会にご登録ください。
配信コンテンツ
・業務に役立つ最新国際規制情報
・当社の新サービス
・事例紹介
・セミナーご案内
配信頻度
月1回




_core_4_3.jpg)
/tuv-rheinland-de19_p05_ivd09-lp_core_4_3.jpg)