Dienstleistungen für In-Vitro-Diagnostika
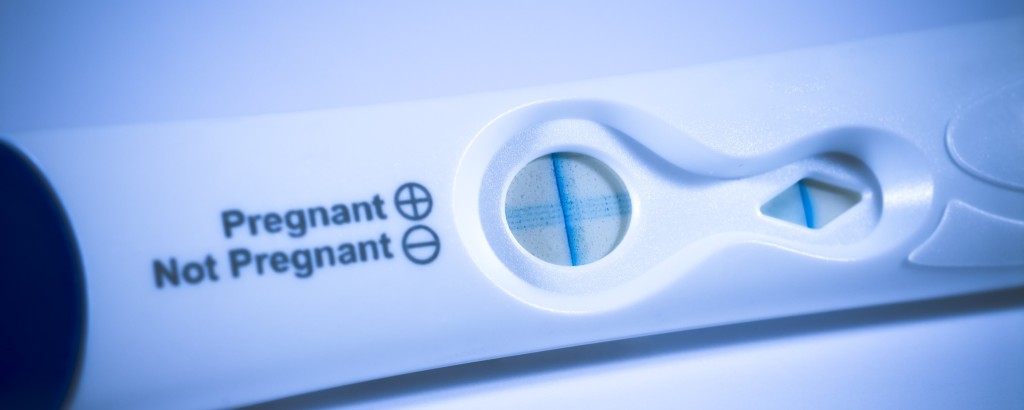
In-Vitro-Diagnostika kommen sowohl zuhause als auch im medizinischen Umfeld zum Einsatz, um Krankheiten, Infekte oder andere Gesundheitsrisiken zu erkennen. Die Zuverlässigkeit und Sicherheit dieser Produkte ist von höchster Priorität für Ihr Unternehmen, um auf dem Markt für Gesundheitswesen wettbewerbsfähig zu bleiben. Mithilfe unseren Dienstleistungen und erstklassigen Spezialisten sorgen Sie für normkonforme Produkte und stärken so das Kundenvertrauen in Ihre Produkte. Durch eine Partnerschaft mit unseren Experten erhalten Sie Zugang zu hochmodernen Laboratorien, wertvolles Fachwissen und einen einmaligen Erfahrungsschatz.
Medizinprodukte - Sicherheit und Prüfungen auf einen Blick

Legen Sie los - Informieren Sie sich über die neuesten Normen, Übergangsfristen für Zertifikate und die wichtigsten Anforderungen für In-Vitro-Diagnostika und Medizinprodukte. Sind Sie bereit für die Zulassung in der EU, den USA und weiteren wichtigen Märkten?
Neue Verordnungen für Medizinprodukte
Unser Portfolio
Kontakt
